БОЛЬ И РОЛЬ КЕТОПРОФЕНА В КЛИНИЧЕСКОЙ ПРАКТИКЕ.
Введение Боль – основная причина обращения к врачу во всем мире. Согласно опубликованным данным, хроническая боль составляет при этом 50% всех случаев в Европе. Вероятнее всего, в дальнейшем эта цифра будет расти, особенно у пожилых людей, общее состояние которых усугубляется различными сопутствующими патологиями и имеет комплексную этиологию. Следовательно, у этих больных возрастает необходимость в безопасном и эффективном обезболивании. Специалисты не могут полностью купировать боль, если не определена ее причина [1]. Международная ассоциация исследований боли (ИАСП) определяет ее как «…неприятное чувство и эмоциональное переживание, связанное с реальным или возможным поражением ткани, или потенциальным поражением» [2]. Каждый пациент воспринимает боль по–своему – в зависимости от раздражителя, предыдущего опыта и текущего психологического и физического состояния. Факторы, вызывающие боль, невозможно не учитывать. Они влияют на наше поведение и умственную деятельность, вызывают чувство тревожности и/или депрессию [3,4].
Боль – основная причина обращения к врачу во всем мире. Согласно опубликованным данным, хроническая боль составляет при этом 50% всех случаев в Европе. Вероятнее всего, в дальнейшем эта цифра будет расти, особенно у пожилых людей, общее состояние которых усугубляется различными сопутствующими патологиями и имеет комплексную этиологию. Следовательно, у этих больных возрастает необходимость в безопасном и эффективном обезболивании. Специалисты не могут полностью купировать боль, если не определена ее причина [1]. Международная ассоциация исследований боли (ИАСП) определяет ее как «…неприятное чувство и эмоциональное переживание, связанное с реальным или возможным поражением ткани, или потенциальным поражением» [2]. Каждый пациент воспринимает боль по–своему – в зависимости от раздражителя, предыдущего опыта и текущего психологического и физического состояния. Факторы, вызывающие боль, невозможно не учитывать. Они влияют на наше поведение и умственную деятельность, вызывают чувство тревожности и/или депрессию [3,4].
Купирование слабой и умеренной боли традиционно основывается на применении нестероидных противовоспалительных препаратов (НПВП) и синтетического неопиоидного анальгетика парацетамола (ацетаминофен). В случаях стойкого синдрома и усиления боли возможен прием слабых (таких как кодеин, декстропропоксифен или трамадол) и даже более сильнодействующих опиоидов (таких как морфин или фентанил) совместно с НПВП или парацетамолом.
НПВП играют основную роль в купировании боли при острых и хронических ревматических заболеваниях, а также при болевом синдроме в послеоперационном периоде (в отличие от парацетамола данные препараты могут также снимать воспаление, связанное с этими видами боли). Хорошо известное побочное воздействие НПВП на желудочно–кишечный тракт можно уменьшить путем тщательного контроля дозировок и длительности лечения, адекватно назначенного лечения, проводимого одновременно с приемом НПВП. С другой стороны, для ослабления побочных эффектов и осложнений со стороны желудочно–кишечного тракта разработаны селективные ингибиторы циклооксигеназы–2 (СОХ–2). К сожалению, крупномасштабные исследования выявили у этих веществ потенциальный еще более серьезный побочный эффект – сердечно–сосудистые осложнения. Европейское агентство по лекарственным средствам (ЕМА), и Агентство по пищевым добавкам и лекарственным средствам (FDA) США разработали стандарты о необходимости соблюдения осторожности и определенных ограничений при выписке ингибиторов СОХ–2, особенно пациентам с повышенным сердечно–сосудистым риском и для длительного приема.
Лизиновая соль кетопрофена
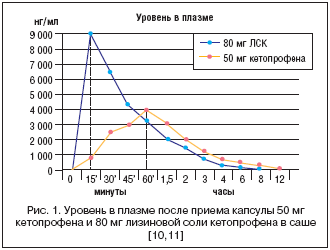
Кетопрофен – это НПВП семейства производных пропионовой кислоты с обезболивающим, противовоспалительным и жаропонижающим действием [5]. Он представляет собой рацемическую смесь, из компонентов которой только S–изомер ингибирует циклооксигеназу; у R–изомера способность к этому намного ниже [6,7]. Солификация кетопрофена лизиновой аминокислотой позволяет улучшить фармакологические характеристики молекулы [8,9]. В частности, лизиновая соль кетопрофена (ЛСК) обладает большей растворимостью, чем кетопрофен; это способствует ускоренной и более полной абсорбции активного вещества. Следовательно, высокий показатель пиковой концентрации вещества в сыворотке крови достигается максимально быстро – через 15 мин. после перорального приема ЛСК (при приеме кетопрофена это происходит через 60 мин.) (рис. 1) [10–12].
Подобный быстрый рост концентрации ЛСК в плазме еще больше ускоряет фармакологическую активность. Выраженное анальгетическое действие ЛСК проявляется уже через 30 мин. после первого приема (статистически значимое по сравнению с плацебо) [13]. Кроме того, высокая растворимость ЛСК в водных средах позволяет вводить инъекционные препараты с аналогичным физиологическим уровнем рН (без необходимости в консервантах) с минимумом реакций раздражения и повреждения тканей в месте инъекции.
Основной механизм обезболивающего действия ЛСК – ингибиция циклооксигеназы (СОХ), а значит, снижение выработки простагландина Е2 (ПГЕ2). Помимо своего воздействия на СОХ кетопрофен ингибирует липоксигеназный путь прохождения каскада арахидоновой кислоты [14], ведущий к снижению синтеза лейкотриенов. Стоит отметить, что лизиновая соль кетопрофена имеет как периферическое, так и центральное действие [15] благодаря ингибиции биосинтеза ПГЕ2 [16,17]. При этом происходит ингибиция и синтазы оксида азота, СОХ в головном мозге. Таким образом, лизиновая соль кетопрофена легко и быстро проникает в центральную нервную систему, проходя гематоэнцефалический барьер в течение 15 мин. (благодаря высокому уровню липофильности) [18]. Недавно специалисты продемонстрировали, что лизиновая соль кетопрофена взаимодействует с системой 5–НТ. Это позволяет предполагать, что данная характеристика – возможное объяснение высокой эффективности данного препарата по сравнению с остальными НПВП [7,15,19].
Эти свойства позволяют оценить лизиновую соль кетопрофена как средство для уменьшения симптомов боли при воспалении мышечно–скелетной системы, возникающих в условиях и острого, и хронического заболевания [20]. Как НПВП, он – мощное и высокоэффективное средство для уменьшения боли при травмах, ортопедических и ревматических патологиях благодаря своим противовоспалительным и обезболивающим свойствам [21].
Применение при хронических
ревматических заболеваниях
Остеоартрит (ОА) – самое распространенное заболевание суставов. В исследовании у 113 пациентов с симптомами коксартроза проведен 4–недельный курс сравнительного лечения с пероральным приемом кетопрофена или индометацина. Исследование показало значительный эффект в снижении боли и улучшении функции суставов, благодаря чему улучшилось качество жизни пациентов. При этом прием кетопрофена оказался безопаснее: меньше пациентов страдали от побочных эффектов или выбыли из исследования [22].
Хорошая эффективность перорального приема ЛСК показана у пациентов с ОА: улучшение состояния наблюдалось у 67,6% пациентов [23]. Более того, анальгетическая эффективность ЛСК при острых состояниях оказалась выше, чем у ацетилсалициловой кислоты: уровень циркуляции β–эндорфина в плазме был выше, а уровень вещества Р – ниже. Эти данные заставляют предполагать, что быстрое и непрерывное обезболивающее воздействие препарата у пациентов с ОА может быть связано именно с уровнем β–эндорфина и вещества Р в системе кровообращения [24].
Ревматоидный артрит (РА) – хроническое воспалительное заболевание периферических суставов, часто ведущее к деградации тканей и разрушению костей и хряща [25]. Терапия направлена на устранение воспалительных последствий аутоиммунной активации с применением противоревматических препаратов, модулирующих заболевание («базисные»). Системный прием глюкокортикоидов эффективен для краткосрочного купирования боли и синовита. Анальгетики применяют для уменьшения боли на всех стадиях заболевания, часто в сочетании с другими средствами лечения, позволяющими контролировать воспалительный процесс. НПВП снижают боль и скованность быстро, не влияя на течение заболевания. Многочисленные данные свидетельствуют, что и классические НПВП, и селективные в отношении СОХ–2 лучше снимают активные признаки и симптомы РА, чем простые анальгетики [26].
В ходе открытого 1–недельного исследования с участием 26 пациентов с РА и стойким синовитом колена было продемонстрировано, что лечение ЛСК и напроксеном (НК) значительно снизило боль и улучшило другие клинические параметры [27]. Более того, уровень синовиального простагландина–2 (ПГЕ2) значительно снизился, особенно в результате приема ЛСК, – на 62,8% (у напроксена на 51,7% соответственно). Общая эффективность и переносимость обоих курсов лечения были почти одинаковы (у ЛСК – несколько выше). Авторы пришли к выводу, что прием ЛСК следует рекомендовать при симптоматическом лечении РА, так как данное исследование подтверждает выраженное обезболивающее и противовоспалительное действие, а также активное ингибирующее влияние ЛСК на уровень ПГ в суставной жидкости (даже по сравнению с напроксеном).
В ходе еще одного исследования с участием 34 пациентов с ревматическими заболеваниями (у 20 из них – РА) специалисты заметили, что пероральный прием ЛСК значительно снижает боль. При этом происходит значительное снижение самопроизвольной боли (p<0,001), болезненности при давлении, функциональных ограничений и продолжительности утренней скованности в течение 10 дней лечения у всех исследуемых пациентов [23]. Более того, у 10 пациентов со стойким синовитом колена ЛСК также успешно проникала в синовиальную жидкость, заметно снижая уровень ПГЕ2 в ней (ингибиция составила около 73%).
Для пожилых пациентов эти данные имеют особое значение. Они часто страдают такими ревматическими заболеваниями, как ОА и РА, которые связаны с различными сопутствующими состояниями, и обычно им требуется длительный прием НПВП. Поэтому вопрос длительного применения важен в отношении безопасности лечения. Следует сказать, что кетопрофен был оценен в обширных исследованиях с участием группы пожилых пациентов. В частности, перспективное исследование, проведенное с определением профиля безопасности кетопрофена в течение 12 мес. с участием 823 пациентов старше 65 лет (с ОА и РА; принимали кетопрофен перорально), показало следующее. В конце исследования 521 (63,3%) пациент остался на той же терапии. Пероральный прием кетопрофена безопасен для пожилых пациентов с артритом при длительном сроке. Показатели уменьшения боли и безопасности оказались теми же, что аналогичные показатели у пациентов, которые были моложе [28].
Безопасность кетопрофена для приема в пожилом возрасте прошла оценку в ходе крупномасштабного открытого исследования с участием около 20 000 пожилых пациентов (старше 60 лет), страдающих различными ревматическими заболеваниями. Пероральный прием кетопрофена в течение 4–х недель обеспечил общую эффективность, оценивавшуюся врачами как «отличная»/«хорошая» в 74% случаев, с «очень хорошим» соотношением риска и пользы у пожилых пациентов в сравнении с остальными группами населения [29].
Подагра – острое воспалительное заболевание суставов, поражающее 1–2% взрослых в промышленно развитых странах. Оно возникает при накоплении кристаллов мочевой кислоты в суставах и других тканях [30–32]. При подагре часто происходят рецидивирующие приступы острого артрита. Иногда это ведет к хронической артропатии, отложению солей и заболеванию почек. С подагрой также связан целый ряд сопутствующих состояний, таких как сердечно–сосудистые заболевания, хроническая болезнь почек и метаболический синдром [32]. В число стандартных средств при острых приступах подагры входят глюкокортикоиды, НПВП и колхицин [32–34]. Для изучения действия кетопрофена при подагрическом артрите проведены несколько исследований, показавших, что внутримышечный или пероральный прием кетопрофена в течение 1 нед. эффективно, быстро и значимо снижает боль [35,36].
В ходе 7–дневного многоцентрового двойного слепого исследования, проведенного для сравнения действия перорального приема кетопрофена и индометацина у 59 пациентов с острым подагрическим артритом, более 90% больных заявили о снижении боли в течение 1–го дня приема препарата. В конце периода исследования у большинства пациентов в обеих группах признано заметное улучшение состояния (оценка проводилась и исследователями, и самими пациентами). Кроме того, исследователи пришли к выводу, что кетопрофен может снимать боль при остром подагрическом артрите в течение 24 ч с той же эффективностью, но с меньшими побочными эффектами, чем индометацин, стандартно назначаемый при этом состоянии [37].
Прием лизиновой соли кетопрофена при острых ревматических
и травматических заболеваниях
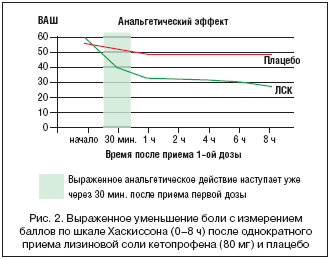
Острые ревматические и травматические заболевания, травмы мягких тканей часто сопровождаются болью, припухлостью и воспалением. Сюда входят: растяжение связок и мышц, тендинит, бурсит (например, латеральный эпикондилит («локоть теннисиста»), регионарный мышечно–лицевой болевой синдром, боль в нижней части спины и нервно–сосудистое ущемление (например, синдром запястного туннеля и синдром верхней апертуры грудной клетки). Было проведено двойное слепое клиническое исследование воздействия перорального приема ЛСК (80 мг/3 раза в сут.) в сравнении с плацебо у 120 пациентов с заболеваниями мягких тканей (тендинит, бурсит и периартрит). В исследовании показано значительное уменьшение ограничений, связанных с болью, функциональных нарушений и болезненной чувствительности к любому прикосновению, а также быстрое и выраженное уменьшение самой боли. Обезболивающее действие ЛСК стало значительным уже через 30 мин. после приема (рис. 2). Более того, из–за побочных реакций на препарат не выбыл ни один пациент. Отмечено, что препарат по–настоящему безопасен – так же, как и плацебо. В заключение стоит сказать, что для пациентов с заболеваниями мягких тканей пероральный прием ЛСК (как показало исследование) эффективен и безопасен [38].
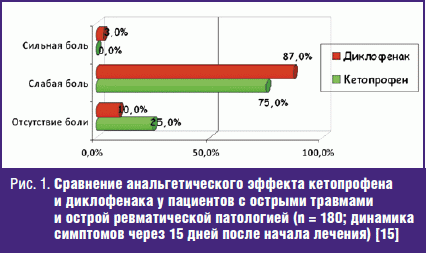
Еще одно сравнительное многоцентровое исследование имело целью определение эффективности и переносимости кетопрофена и диклофенака натрия при острых ревматических и травматических состояниях. У 180 пациентов, принимавших кетопрофен либо диклофенак в течение 15 дней (сначала в форме внутримышечных инъекций, затем перорально), отмечено снижение симптомов боли. Кетопрофен признан более эффективным как анальгетик, используемый при большинстве патологических состояний. Исследование также показало, что кетопрофен переносится лучше, чем диклофенак. Оценка «отлично/хорошо» присвоена ему по результатам, полученным у наибольшего процента пациентов [39].
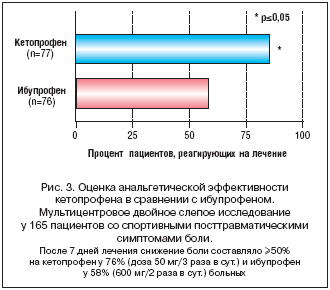
Для сравнения обезболивающего эффекта 1–недельного приема кетопрофена (50 мг/3 раза в сут. перорально) и ибупрофена (600 мг/2 раза в сут. перорально) проведено многоцентровое двойное слепое исследование с участием 165 пациентов со спортивными травмами. У этих пациентов полученные травмы вызвали ряд болезненных поражений, таких как тендинит или теносиновит, эпикондилит, травматический бурсит, растяжение связок или ушиб. Полученные результаты показали, что уже после первого (перорального) приема кетопрофен значительно быстрее уменьшает боль (на 1,1 часа) по сравнению с ибупрофеном. Выяснилось также, что максимальный балл снижения боли у кетопрофена намного выше. В течение 6 ч у 76% пациентов, принимавших кетопрофен, отмечено 50% снижение боли; у тех, кто принимал ибупрофен, этот показатель составил 58% (p<0,05). Максимальная степень снижения боли при приеме кетопрофена достигалась быстрее, чем при приеме ибупрофена (рис. 3) [40].
Боль в нижней части спины
Боль в нижней части спины – одно из наиболее распространенных состояний, встречающихся в клинической практике. Основной способ лечения – медикаментозный. По продолжительности острая боль в нижней части спины обычно определяется как симптом, сохраняющийся не менее 6 нед., подострая боль – от 6 до 12 нед., хроническая боль в нижней части спины – от 12 нед. и дольше. Для большинства пациентов, независимо от длительности симптомов, обезболивающим средством первого выбора служат парацетамол (ацетаминофен) и НПВП. Результаты перорального и внутримышечного приема кетопрофена изучались в целом ряде различных клинических исследований с участием пациентов, страдавших люмбаго.
В сравнительном 1–недельном исследовании эффективности и переносимости внутримышечного приема кетопрофена и индометацина принимали участие 115 пациентов с острой болью в нижней части спины. Результаты исследования показали, что кетопрофен значительно снижает общую (глобальную) боль и обеспечивает более устойчивое обезболивание, чем индометацин. Кроме того, следует отметить, что уже через 1 ч после приема в группе кетопрофена значительное ослабление боли почувствовали больше пациентов, чем в группе, принимавшей индометацин (61 и 46,9% соответственно) [41]. Еще одно исследование с участием 155 пациентов с хронической болью в поясничной области показало, что пероральный прием кетопрофена (150 мг/2 раза в сут.) дает более высокие показатели улучшения состояния, чем диклофенак (75 мг/2 раза в сут.) через 1 нед. после приема. Это значит, что благодаря кетопрофену обезболивание наступало раньше, чем при приеме диклофенака (у 71,4 и 62,36% пациентов соответственно).
Применение лизиновой соли
кетопрофена в послеоперационном периоде
Лечение НПВП широко применяется и в ортопедической клинической практике. Однако для послеоперационного периода в ортопедической хирургии характерно наличие не только болей, но и целого ряда терапевтических взаимодействий, осложнений, репаративных явлений в костных и мягких тканях. Кроме того, врачи назначают пациентам различные ортопедические и психотропные средства, с которыми НПВП могут взаимодействовать [42].
Внутривенный прием. Обезболивающий эффект внутривенного приема кетопрофена исследовался Кастаньерой с сотрудниками (1988 г.) с участием 60 пациентов после ортопедической операции. Из них у 16 операция была проведена на спинном мозге (диски, спинномозговая стабилизация), у 15 – на бедре (протезирование и введение гвоздя при переломе бедра), у 15 – на колене (протезирование, остеотомия, пластика связок), у 14 – на стопе и лодыжке (остеосинтез или операция в связи с вальгусной деформацией первого пальца стопы). Пациенты принимали кетопрофен (2,5 мг/кг), вводившийся в форме инъекции сразу же после возникновения боли (Т0) [43]. Интенсивность боли определялась по Визуальной аналоговой шкале (ВАШ) и пятибалльной Шкале вербальной оценки (ШВО). Полученные результаты показали снижение интенсивности боли более чем на 50% через 15 мин. и на 85% через 2 и 3 ч после инъекции (p<0,001). Максимальное обезболивание было обеспечено через 120 мин. после операции на колене и бедре и через 180 мин. – после операции на спинном мозге и ножной стопе/лодыжке. Длительность обезболивающего эффекта в той и другой группе оказалась аналогичной (8,5±1,5 ч). В заключение отметим, что уменьшение боли наблюдалось в 96,6% случаев. Это значит, что обезболивание, наблюдаемое одновременно с противовоспалительным действием лизиновой соли кетопрофена, делает его внутривенный прием безопасным и эффективным средством купирования боли в послеоперационном периоде. Это позволяет еще раз убедиться в том, что препарат снимает боль не только на периферическом, но и на центральном уровне.
Внутримышечный прием. В 1992 г. Манани и коллеги провели исследование с участием 3 групп пациентов (по 25 в каждой) для сравнения эффективности внутримышечного приема кетопрофена и напроксена с одной стороны и плацебо – с другой. Исследование проводилось в случаях острой ортопедической боли в послеоперационном периоде, в течение первых 4 ч после появления умеренной или сильной боли [44]. В случае неэффективности 2 доз НПВП пациенту давали морфий (10 мг внутримышечно). Исследование показало, что кетопрофен заметно снижает послеоперационную боль. Это означает снижение потребности в дополнительных дозах принимаемого препарата и последующих дозах морфия. Как средство обезболивания, кетопрофен представляется эффективнее напроксена, так как его анальгетические свойства сильнее. В свою очередь, напроксен, обладающий более мощными противовоспалительными свойствами, может с большей выгодой использоваться как средство от боли, возникающей после хирургических операций [44].
В исследовании Шаха и соавт. проводили сравнение эффективности внутримышечного приема кетопрофена и диклофенака натрия (2003 г.) [45]. 100 прооперированных пациентов внутримышечно получали кетопрофен (100 мг/2 раза в сут.) или диклофенак (75 мг/ 2 раза в сут.) в течение 3 дней. В результате при приеме каждого из препаратов обезболивание наступало в течение 15–30 мин. При этом кетопрофен показал превосходство перед диклофенаком. На него пациенты начинали реагировать раньше (через 15–20 мин. в 92% случаев, в отличие от 84% в группе диклофенака) (рис. 4). Исследование показало, что у кетопрофена обезболивающий эффект сохраняется дольше (12 ч) в большем числе случаев, чем у диклофенака (а значит, снижалась потребность в дополнительных дозах опиоида). Следовательно, обезболивающее действие кетопрофена мощнее, чем у диклофенака.
Послеоперационный кальциноз и процесс репарации костных тканей. После ортопедической операции могут возникать различные осложнения (немедленного, отсроченного или хронического характера). Среди них мы хотели бы особо остановиться на перипротезном кальцинозе бедра и остеопении (например, атрофия Зудека). Эти состояния потенциально влияют на любой участок кости после длительного обездвиживания (гипсовая повязка или ортез) или лишения механической стимуляции.
Послеоперационное состояние пациентов, проходящих ортопедическое лечение, характеризуется репаративными процессами, затрагивающими главным образом костную ткань. Срастание переломов и заживление дефектов кости характеризуется регенерацией костной ткани. Это явление происходит благодаря стимуляции специальных факторов роста, воздействующих на клетки стромы, возникающих при воспалительном процессе, а также определенным физиологическим состояниям, благоприятствующим формированию костной матрицы.
Есть данные, свидетельствующие, что кетопрофен, по–видимому, не участвует в подобных процессах в организме животных [46,47]. В ходе одного исследования проведено сравнение эффективности кетопрофена и плацебо (в контрольной группе) при снятии дефектов большой берцовой кости у крыс. При этом был проведен анализ плотности костной массы в течение периода до 21 сут. после остеотомии [46]. В контрольной группе оптическая плотность со временем значительно возросла. В группе кетопрофена та же корреляция не наблюдалась, так как здесь в течение первой недели оптическая плотность значительно возросла, а затем (начиная с 21–х сут.) начала снижаться.
Исследователи сделали вывод, что кетопрофен безопасен при применении в течение первых 21 сут. после операции. Аналогичные результаты были заявлены Мацумото и соавт. (2008 г.).
Выводы
В клинической практике большинство пациентов с хроническими ревматическими заболеваниями – это люди пожилого возраста. Они страдают от различных других заболеваний (например, сердечно–сосудистых и метаболических). Такие пациенты могут принимать комплекс препаратов, потенциально взаимодействующих с НПВП. Как показала практика, пожилые пациенты переносят лизиновую соль кетопрофена хорошо; никакого взаимодействия с антикоагулянтами при этом не наблюдается.
Лизиновая соль кетопрофена широко применяется для купирования боли в послеоперационном периоде. Она эффективна и безопасна также при острой ревматической боли (включая бурсит, тендинит, периартрит и боль в нижней части спины), обеспечивая быстрое начало процесса обезболивания. Эффективность и безопасность лизиновой соли кетопрофена подтверждает также ряд исследований, подчеркивающих ее высокую эффективность и очевидные преимущества по сравнению с другими НПВП (такими как диклофенак и ибупрофен). Лизиновая соль кетопрофена способна сильнее и быстрее уменьшать боль, она имеет прекрасный общий профиль переносимости. Таким образом, можно сделать вывод, что лизиновая соль кетопрофена – оптимальный выбор при снятии боли у данной группы пациентов. Доказана также ценность лизиновой соли кетопрофена как вещества, улучшающего состояние пациентов после ортопедических операций. Что касается снижения боли в послеоперационном периоде, следует отметить, что благодаря лизиновой соли кетопрофена появляется возможность снизить дозировку опиоидов или полностью заменить их. Тем самым мы можем избежать побочных эффектов подобной терапии. В послеоперационных условиях лизиновая соль кетопрофена действует намного эффективнее и дольше диклофенака.
В России лизиновая соль кетопрофена зарегистрирована под двумя торговыми названиями: Артрозилен – нестероидное противовоспалительное средство, которое применяется для лечения острых и хронических заболеваний суставов и позвоночника у пациентов старше 18 лет, и ОКИ – противовоспалительное средство для лечения симптомов гриппа, ОРВИ, болевого синдрома различной степени выраженности и локализации у пациентов старше 6 лет*.
Литература
1. Merskey H., Bogduk N. (Eds). Classification of chronic pain: descriptions of chronic pain syndromes and definitions of pain terms, 2nd ed. – Seattle: IASP Press, 1994.
2. Waddell G., Newton M., Henderson I. et al. A Fear Avoidance Beliefs Questionnaire (FABQ) and the role of fear avoidance beliefs in chronic low back pain and disability // Pain. – 1993. – Vol. 52. – P. 157–168.
3. Turk D.C., Wilson H.D. Fear of pain as a prognostic factor in chronic pain: conceptual models, assessment, and treatment implications // Curr. Pain. Headache Rep.– 2010.– Vol. 14.– P. 88–95.
4. Colvin L.A., Lambert D.G. Pain medicine: advances in basic sciences and clinical practice // Br. J. Anaesth. – 2008.– Vol. 101. – P. 1–4.
5. McCormack K.J., Brune K. Dissociation between the anti–nociceptive and anti–inflammatory effects of the nonsteroidal anti–inflammatory drugs: a survey of their analgesic efficacy // Drugs. – 1991.– Vol. 41.– P. 533–547.
6. Barbanoj M.J., Antonijoan R.M., Gich I. Clinical pharmacokinetics of dexketoprofen // Clin. Pharmacokinet. – 2001.– Vol. 40.– P. 245–262.
7. Cabre F., Fernandez M.F. et al. Analgesic, antiinflammatory, and antipyretic effects of S(+)–ketoprofen in vivo // J. Clin. Pharmacol. – 1998.– Vol. 38.– P. 3S–10S.
8. Panerai A. [Symptoms of pain].– Torino: Edizioni Minerva Medica, 1999.
9. Marmo E., Ottavo R., Giordano L. et al. Experimental assessment of some pharmacodynamic features of ketoprofen lysine. Pain relief activity, antipyretic effects, antiinflammatory activity, antiplatelet aggregation activity and interference with the biosynthesis of prostaglandins.– Torino // Arch. Sci Med. – 1980.– Vol. 137.– P. 387–404.
10. Natale et al. Studio in soggetti volontari sani della biodisponibilita relativa e della farmacocinetica di ketoprofen dopo somministrazione per via orale sotto forma di sale di lisina in formulazione bustine di granulato (dose singola e ripetuta) e in forma di ketoprofen acido formulato in capsule. Data on file 1991.
11. Rusca et al. Two way crossover, randomised, single dose comparative bioavailability study of ketoprofen lysine salt after oral administration to healthy volunteers of both sexes. (IPAS–KETO–025–94), data on file 1994.
12. D’arienzo M., Pennisi M., Zanolo G., Borsa M. Ketoprofen lysine: ketoprofen serum levels and analgesic activity // Drugs. Exp. Clin. Res. –1984.– Vol 10. – P. 863–866.
13. Veys E.M. 20 Years’ Experience with ketoprofen // Scan. J. Rheumatol. – 1991.– Vol. 90.– P. 3–44.
14. Walker J.L. Interrelationships of SRS–A production and arachidonic acid metabolism in human lung tissue // Adv. Prostaglandin Thromboxane Res. – 1980.– Vol. 6.– P. 115–119.
15. Diaz Reval M.I. et al. Evidence for a central mechanism of action of S(+)–ketoprofen // Eur. J. Pharmacol.– 2004.– Vol. 483.– P. 241–248.
16. Bjorkman R. Central antinociceptive effects of non–steroidal antiinflammatory drugs and paracetamol: experimental studies in the rat // Acta Anaesthesiol. Scand.– Suppl 1995.– Vol. 103.– P. 1–44.
17. Ossipov M.H., Jerussi T.P., Ren K. et al. Differential effects of spinal (R)–ketoprofen and (S)–ketoprofen against signs of neuropathic pain and tonic nociception: evidence for a novel mechanism of action of (R)–ketoprofen against tactile allodynia // Pain. – 2000.– Vol. 87.– P. 193–199.
18. Kokki H., Karvinen M., Jekunen A. Diffusion of ketoprofen into the cerebrospinal fluid of young children // Paediatr. Anaesth. – 2002.– Vol. 12.– P.313–316.
19. Kubota T., Komatsu H., Kawamoto H., Yamada T. Studies on the effects of antiinflammatory action of benzoylhydrotropic acid (ketoprofen) and other drugs, with special reference to prostaglandin synthesis // Arch. Int. Pharmacodyn. Ther. – 1979.– Vol. 237.– P. 169–176.
20. Kantor T.G. Ketoprofen: a review of its pharmacologic and clinical properties // Pharmacotherapy.– 1986.– Vol. 6.– P. 93103.
21. Dieppe P., Lohmander L. Pathogenesis and management of pain in osteoarthritis // Lancet.– 2005.– Vol. 365.– P. 965–973.
22. Marcolongo R., Canesi B., Ferri S. et al. Efficacy and tolerability of ketoprofen 200 mg controlled release cps vs indomethacin 50 mg cps in patients with symptomatic hip osteoarthritis. A multicentre study // Minerva Med. – 1997.– Vol. 88.– P. 383–391.
23. Chevallard M. et al. Effectiveness and tolerability of ketoprofen lysine, a once a day, in patients with rheumatic disorders // Drugs Exptl. Clin. Res.– 1987.– Vol. 13.– P. 293–296.
24. Torri G., Cecchettin M., Bellometti S., Galzigna L. Analgesic effect and beta–endorphin and substance P levels in plasma after short–term administration of a ketoprofen–lysine salt or acetylsalicylic acid in patients with osteoarthrosis // Curr. Ther. Res. – 1995.– Vol. 56.– P. 62–69.
25. Sarzi–Puttini P., Atzeni F. Rheumatoid arthritis from the clinical perspective // Reumatismo.– 2004.– Vol. 3.– P. 22–25.
26. Wienecke T., Gotzsche P.C. Paracetamol versus non–steroidal anti–inflammatory drugs for rheumatoid arthritis // Cochrane Database Syst. Rev .– 2004.– Vol. 1: CD003789.
27. Carrabba M., Chevallard M. et al. Ketoprofen lysine in rheumatoid arthritis: efficacy and tolerability of two therapeutic schedules with evaluation of synovial prostaglandin levels // Current. Ther. Res. – 1987.– Vol. 42.– P. 70–76.
28. Schattenkirchner M. Long–term safety of ketoprofen in an elderly population of arthritic patients // Scand. J. Rheumatol. – 1991.– Vol. 91.– P. 27–36.
29. Le Loet X. Safety of ketoprofen in the elderly: a prospective study on 20 000 patients // Scand. J. Rheumatol. – 1991.– Vol. 18.– P. 21–27.
30. Ieber J.D., Terkeltaub R.A. Gout: on the brink of novel therapeutic options for an ancient disease // Arthritis. Rheum. – 2004.– Vol. 50.– P. 2400–2014.
31. Teng G.G., Nair R., Saag K.G. Pathophysiology, clinical presentation and treatment of gout drugs. – 2006.– Vol. 66.– P. 1547–1563.
32. Richette P., Bardin T. // Gout. Lancet. – 2010.– Vol. 375.– P. 318–328.
33. Roddy E., Zhang W., Doherty M. The changing epidemiology of gout // Nat. Clin. Pract. Rheumatol. – 2007.– Vol. 3.– P. 443–449.
34. Zhang W., Doherty M., Bardin T. et al. EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT) // Ann. Rheum. Dis.– 2006.– Vol. 65.– P. 1312–1324.
35. Siegmuth W., Placheta O. Double–blind trial: ketoprofen versus phenylbutazone in acute gouty arthritis (German) // Wien Klin. Wochenschr. – 1976.– Vol. 88.– P. 535–539.
36. Cobra C.J., Cobra J. Comparative study of ketoprofen and penylbutazone in gout attacks (French) // Rumatologie.– 1980.– Vol. 47.– P. 141–146.
37. Altman R.D et al. Ketoprofen versus indomethacin in patients with acute gouty arthritis: a multicenter, double blind comparative study // J. Rheumatol. – 1988.– Vol. 15.– P. 1422–1426.
38. Fatti et al. Valutazione dell’efficacia e tollerabilita di ketoprofen sale di lisina in formulazione in bustine per uso orale in pazienti con affezioni flogistiche dell’apparato muscolo–scheletrico (Reumatismo extra articolare) studio doppio cieco comparativo a placebo. Data on file, 1991. Evaluation of the effectiveness and tolerability of ketoprofen lysine salt formulation in sachets for oral use in patients with inflammatory diseases of the musculo–skeletal system, double–blind study compared with placebo.
39. Jokhio I.A., Siddiqui K.A., Waraich T. et al. Study of efficacy and tolerance of ketoprofen and diclofenac sodium in the treatment of acute rheumatic and traumatic conditions // J. Pak. Med. Assoc. – 1998.– Vol. 48.– P. 373–376.
40. Robbins D., Taylor M.A.H., Brown M.D., McIlwain H. Ketoprofen versus ibuprofen for acute sports injuries: are there differences between nonsteroidal anti–inflammatory drugs? // Curr. Ther. Res. – 1990.– Vol. 48.– P. 780–789.
41. Levernieux J., Beaslay N., Seze S. Comparative study between injectable ketoprofen and indometacine in the treatment of lomboradicular pain // Revue Internationale de rhumatologie. – 1986.– Vol. 16.– P. 171–175.
42. Matsumo S., Kaneda K., Norhara Y. Clinical evaluation of ketoprofen (Orudis) in lumbago a double–blind comparison with diclofenac sodium // Br. J. Clin. Pract. – 1981.– Vol. 35.– P. 266.
43. Castagnera L., Vital J.M., Macouillard G. et al. Study of the analgesic effectiveness of intravenous ketoprofen in orthopedic surgery // Sem. Hop. Paris. – 1988.– Vol. 32.– P. 2179–2182.
44. Manani G., Corliano L., Zanette G. et al. Ketoprofen and Naproxen in acute postoperative orthopedic pain // Acta Anaesth. Italica. – 1993.– Vol. 44.– P. 73–80.
45. Shah S., Soomro M., Kella U. et al. Comparative study of non–steroidal anti inflammatory drugs in postoperative pain // J. Surg. Pak. Dec. – 2003.– Vol. 8.– P. 2–5.
46. Martins M.V., da Silva M.A., Medici Filho E. et al. Evaluation of digital optical density of bone repair in rats medicated with ketoprofen // Braz. Dent. J. – 2005.– Vol. 16.– P. 207–212.
47. Matsumoto M.A., De Oliveira A., Ribeiro Junior P.D. et al. Short–term administration of non–selective and selective COX–2 NSAIDs do not interfere with bone repair in rats // J. Mol. Histol. – 2008.– Vol. 39.– P. 381–387.














































